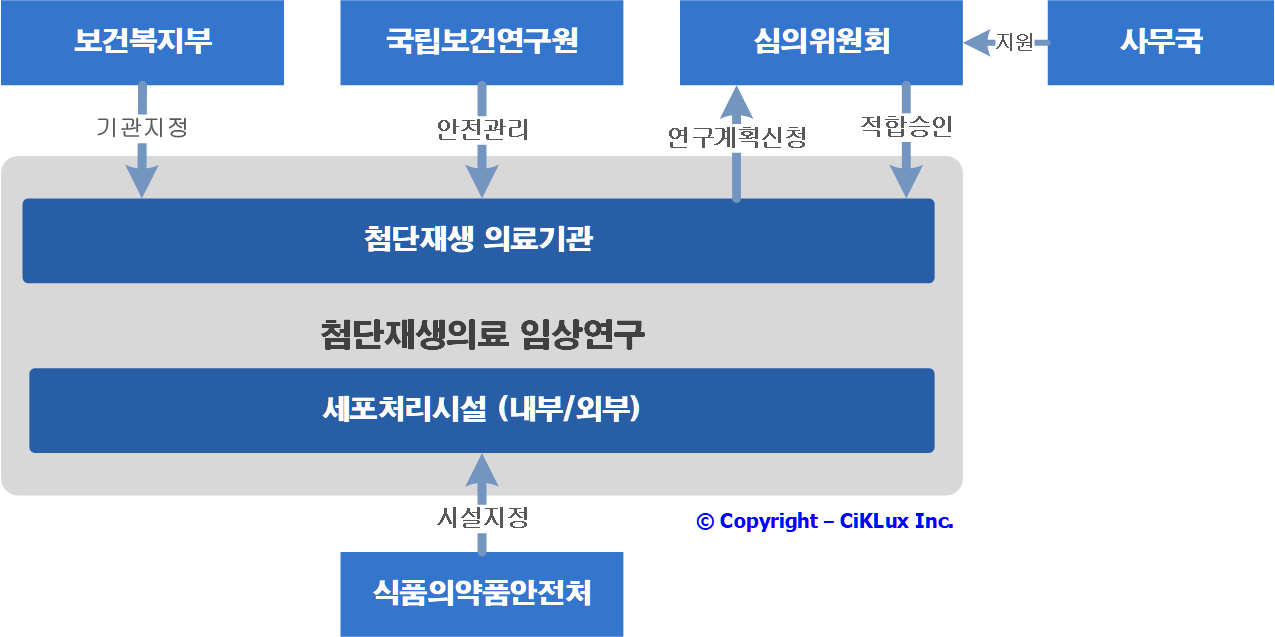
첨단재생바이오법 기반 임상연구 승인 및 안전관리 체계
첨단재생의료 (Advanced Regenerative Medicine Research) 기관지정 및 임상연구 컨설팅 서비스
사이클룩스는 국립보건연구원에서 실시한 첨단재생의료실시기관 현장점검 세부지침 개발 연구에 주관기관으로 참여하여 현장점검 세부지침의 개발 과정에서 첨단재생의료실시기관 관리체계에 대한 지식과 경험을 축적하였으며 첨단재생의료 실시기관지정 및 기관 audit에 대한 컨설팅을 통해 첨단재생의료 사업 활성화에 의한 국가 경쟁력 제고에 이바지 하겠습니다.
▶ 머니투데이 - 사이클룩스, 첨단재생의료 임상연구 현장점검 세부지침 개발


✔ 첨단재생의료 (▶ 첨단재생의료포털)
• 첨단재생의료는 “사람의 신체 구조 또는 기능을 재생, 회복 또는 형성하거나 질병을 치료 또는 예방하기 위하여 인체세포등을 이용하여 실시하는 세포치료, 유전자치료, 조직공학치료 등 대통령령으로 정하는 것(첨단재생의료 및 첨단바이오의약품 안전 및 지원에 관한 법률 제2조 1)”으로 기존 합성의약품이나 의료기기와 다른 특성을 갖는 차세대 유망의료기술로 국내외 시장이 급격히 성장
• 첨단재생의료 임상연구란 환자의 삶의 질 향상 및 질병 치료 기회 확대를 목적으로 사람을 대상으로 첨단재생의료에 관하여 실시하는 연구로서 다음 각 목의 구분에 따라 대통령령으로 정하는 ① 사람의 생명 및 건강에 미치는 영향이 불확실하거나 그 위험도가 큰 임상연구, ② 사람의 생명 및 건강에 부정적인 영향을 미칠 우려가 있어 상당한 주의를 요하는 임상연구, ③ 사람의 생명 및 건강에 미치는 영향이 잘 알려져 있고 그 위험도가 미미한 임상연구를 말한다.
• 대한민국은 이미 줄기세포 활용 기술에 대해 경쟁력을 보유하고 있어 해당 기술을 포함한 ‘첨단재생바이오법’을 2019년에 재정하는 등 정책적 지원도 확대
• 국내의 경우 세포치료제, 특히 줄기세포치료제 분야에 개발이 집중되어 있고, 상업적 목적의 임상시험 비율이 높아 다양한 첨단재생의료의 활성화를 위한 노력이 필요
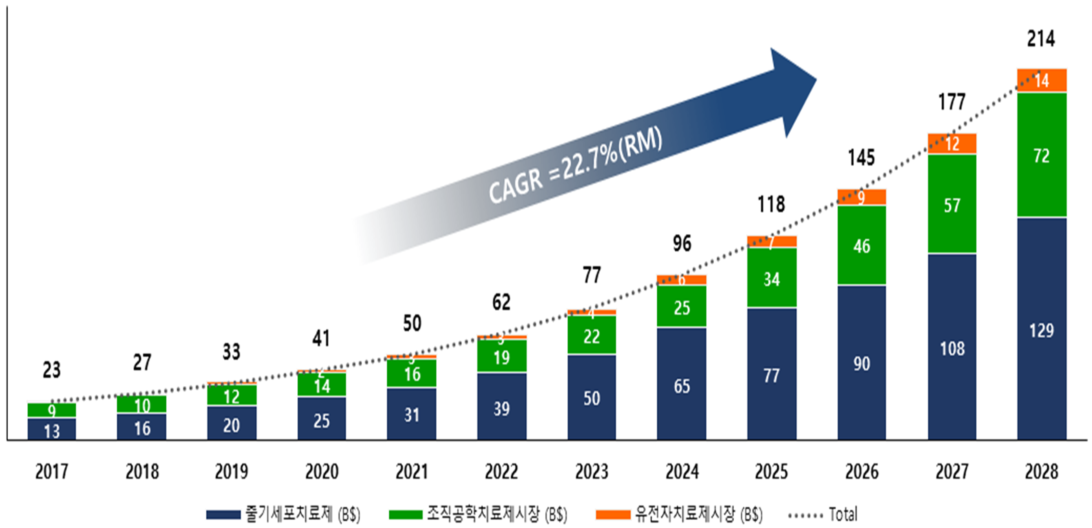
• 글로벌 재생의료 개발 기업 수는 유전자, 세포 및 조직 기반 치료제 기업을 모두 포함하여 2021년 기준 총 1,308개사로 파악됨. 현재 해당 기업을 중심으로 진행되고 있는 임상은 전세계적으로 1,171건으로, 그 중 142건(12%)이 임상 3상 진행 중
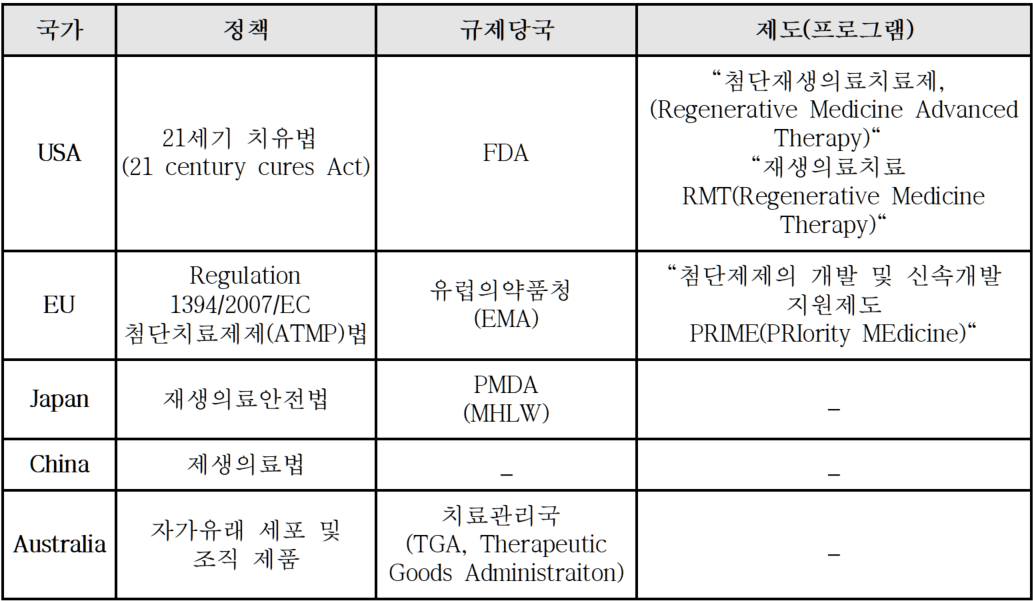
첨단재생의료 관련 법규
▶ 첨단재생의료 및 첨단바이오의약품 안전 및 지원에 관한 법률
▶ 첨단재생의료 및 첨단바이오의약품 안전 및 지원에 관한 법률 시행령 (대통령령)
▶ 첨단재생의료 연구계획 작성 제출 및 심의 등에 관한 규정
▶ 첨단재생의료실시기관 지정 및 세포처리업무 관련 준수사항 등에 관한 규정
▶ 첨단재생의료 및 첨단바이오의약품 심의위원회 운영규정
✔ 첨단재생의료 임상연구
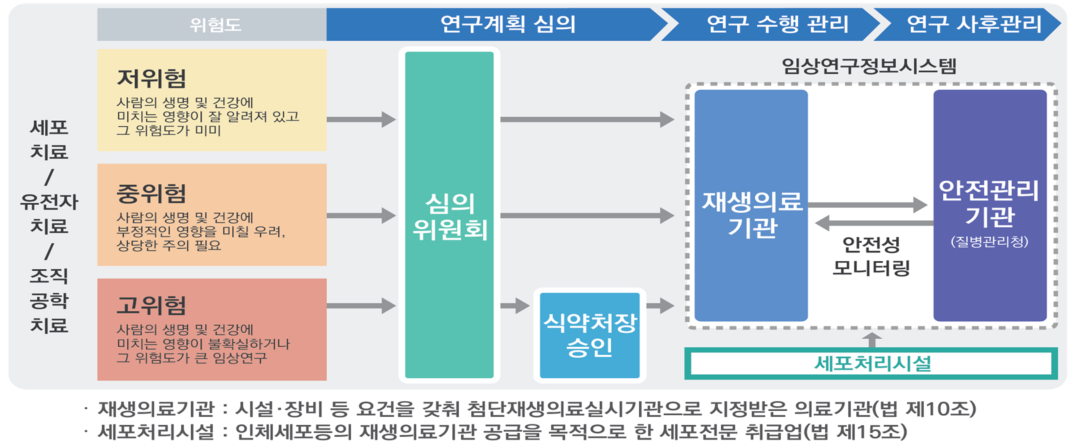
• 첨단재생의료 임상연구는 첨단재생의료실시기관으로 지정받은 곳에서만 수행하여야 하며 첨단재생의료 임상연구를 수행하기 위하여 우선 임상연구를 수행하는 기관이 첨단재생의료실시기관으로 지정받아야 함
• 보건복지부에서 재생의료기관 지정을 위한 서류검토 및 현장점검 시 ‘첨단재생의료실시기관 지정 신청 공고’에 따른 ‘신청서류 사전확인 체크리스트’를 사용하고 있으며, 해당 체크리스트는 시설/장비, 인력, 표준작업지침서로 구분되어 있음
• 첨단재생의료 임상연구는 첨단재생의료실시기관으로 지정받은 내용 하에서 수행하고 있으며, 지정 이후 실시기관의 변경 내용이 임상연구에 적절히 반영되어 적용되고 있는지 확인하여야 함 (2021년 국립보건연구원 지정기관 점검 checklist 개발)